基礎研究
慢性腎臓病に伴うミネラル骨代謝異常に関する研究
研究の背景
慢性腎臓病(CKD)患者は、CKDの進展に伴って、種々のカルシウム・リン代謝異常、副甲状腺機能異常、そして骨代謝異常を合併します。このCKD伴う骨・ミネラル代謝異常症は、CKD-MBDという包括的な概念として近年見直され、CKDの進展のみならず心血管病の発症を介して生命予後にも悪影響を及ぼす全身性疾患であると位置づけられるようになりました。CKD-MBDは今やCKD領域の花形に躍り出たと言えます。
私たちの研究室におけるCKD-MBDの研究は、1996年に遡り、当時血液透析患者の重要な合併症であった二次性副甲状腺機能亢進症の適切な治療と管理方法を明らかにすることを目標にスタートしました。2017年の現時点においては、CKD-MBDの中でも特に注目されている血管石灰化の病態機序の解明そして治療法の開発を目指して基礎研究を続けています。ここでは、これまでに我々が行ってきた血管石灰化に関する成果を簡単に紹介させていただきます。
私たちの研究室におけるCKD-MBDの研究は、1996年に遡り、当時血液透析患者の重要な合併症であった二次性副甲状腺機能亢進症の適切な治療と管理方法を明らかにすることを目標にスタートしました。2017年の現時点においては、CKD-MBDの中でも特に注目されている血管石灰化の病態機序の解明そして治療法の開発を目指して基礎研究を続けています。ここでは、これまでに我々が行ってきた血管石灰化に関する成果を簡単に紹介させていただきます。
研究成果 2012年~2014年
CKDでは全身の酸化ストレスが亢進しています。CKDで亢進した酸化ストレスは、腎障害の進展はもとより、その他のCKDの合併症の病態に深く関係していることが報告されています。我々はCKDで亢進している酸化ストレスがCKDに合併する血管石灰化をも促進しており、さらに、酸化ストレスを低減すればCKDに合併する血管石灰化の進展を抑制できるのではないか考えました。
このことを実証するために、まず、ラットにアデニンを継続的に食餌負荷することによって慢性進行性の腎障害を誘導しました。このラットでは、CKDの進行とともに血中および動脈組織中の酸化ストレスが亢進し、大動脈中膜には高度の石灰化を発症しました。このラットに抗酸化薬であるテンポールを投与すると、投与しないラットに比べて、血中および動脈中の酸化ストレスは軽減され、さらに血管石灰化の程度も減少しました(図1)。さらに石灰化動脈における平滑筋細胞の骨芽細胞用細胞への形質変化も抑制されていることがわかりました(図2)。

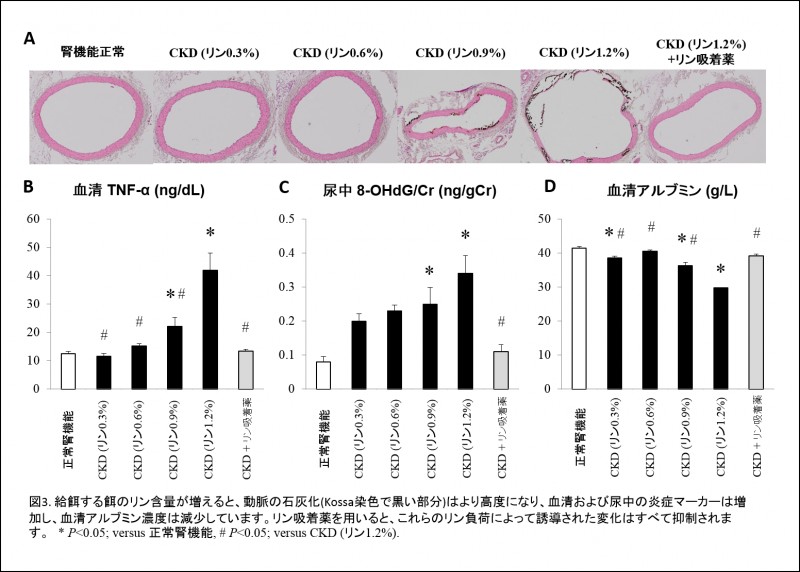
リンの排泄臓器は腎臓であるため、CKDが進行するとリンが体内に蓄積し、血清リン濃度が最終的には上昇します。CKDで蓄積したリンが血管石灰化を強力に促すことは今や周知の事実であり、石灰化の進展を抑制するためにはリン摂取量を制限することが第一義的に重要であると広く認識されるようになりました。一方で、我々は先の動物実験において、高度な血管石灰化を示すラットほどより栄養状態が悪く、かつ血清リン濃度も高いことに気が付きました。私たちはこの事実を重要視し、CKDを有する場合、リンの負荷量を増加させると炎症が誘導され、栄養状態が悪化するとともに、血管石灰化も進行するという仮説を立て、以下の実験を実施するに至りました。
餌中のリン含量がそれぞれ0.3%, 0.6%, 0.9%, 1.2%であるアデニン0.3%含有餌をそれぞれラットに投与し、血清ミネラルマーカー、炎症マーカー、そして血管石灰化を調べました。非常に興味深いことに、餌中のリン含量が増加するにつれ、血清リン、副甲状腺ホルモン、FGF23濃度は増加し、炎症マーカーである血清TNF-aや尿中8-OHdG濃度は上昇し、血管石灰化もより高度になること、一方で、体重、栄養の指標である血清アルブミン濃度は餌中のリン含量依存性に低下することが明らかになりました(図3)。また、これらのリン負荷に伴う一連の反応は、リン吸着薬の投与によって抑制されることがわかりました。以上のことから、CKD合併時には、リン摂取量が増加するほど、炎症や栄養障害も高度になることを動物実験で示し、CKD-MBDが炎症や栄養状態にも影響するのではないかと考えています。
研究成果 2015年~
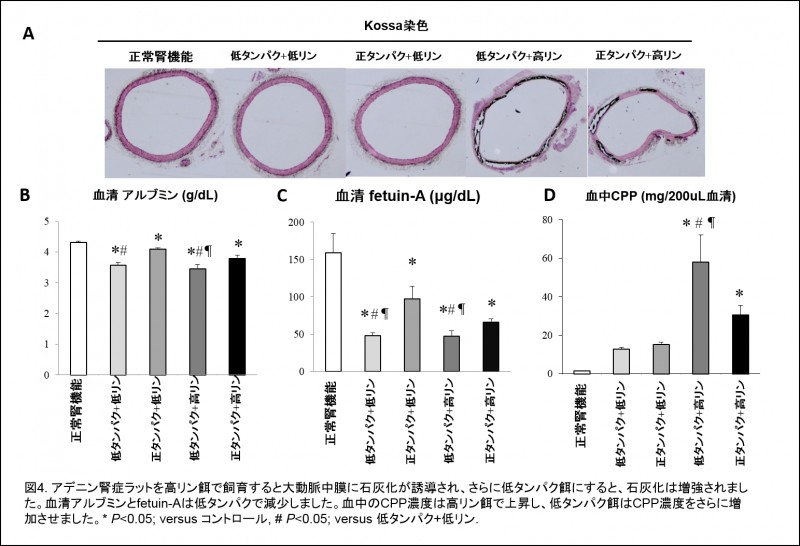
低タンパク食療法は、CKDの進行を抑制する重要な食事療法として広くCKD患者で行われています。一方、蛋白制限にともなって十分な量のカロリー摂取が妨げられると、栄養状態が悪化するため、かえってCKD患者の生命予後を悪くすると考えられています。我々は、先の実験において、栄養状態の悪いラットでは血管石灰化が高度であることを確認し、栄養不良そのものが血管石灰化を促進するのではないかと推測しました。その根拠は、血管石灰化の進展には石灰化抑制蛋白の減少が不可欠であること、さらに栄養障害ではこれらの蛋白量が減少していることに基づきます。我々は、栄養障害で減少する石灰化抑制蛋白の中でも特にfetuin-Aという肝臓で産生される蛋白に注目しました。
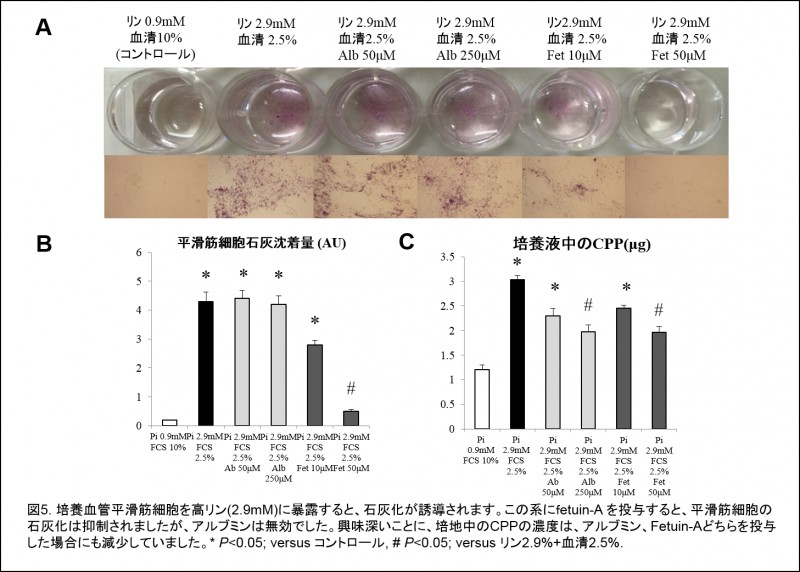
低タンパク餌を給餌したラットは、蛋白制限をしなかったラットと比べて高度の血管石灰化を発症するとともに、より高度の栄養障害を発症しました。栄養障害が高度のラットにおいては、血中のfetuin-A濃度も高度に低下していました(図4)。培養血管平滑筋細胞を用いた実験では、fetuin-Aの投与は高リン低タンパク培地で培養された血管平滑筋細胞のカルシウム沈着を抑制し、同時に石灰化誘導の本体ではないかと目されているCPPをも減少させました(図5)。以上の結果から、低タンパク餌は、栄養障害に伴ってfetuin-Aの血中濃度が減少し、CPPが増加することによって血管石灰化を進展させるというストーリーを考えています。
超低タンパク食は、低タンパク食よりも蛋白摂取量をさらに制限する食餌療法です。低タンパク食よりもCKDの進展抑制効果は大きい可能性があるものの、栄養障害を起こす危険性もより高いことが知られています。さらに、動物実験では超低タンパク餌を給餌されたラットは、きわめて高度の血管石灰化を発症するため、超低タンパク食が失敗した場合には人においても同様の結果に至ることが懸念されています。我々は、超低タンパク食であっても、リンを厳格に管理すれば、血管石灰化を発症しないのではないかと考えました。
超低タンパク餌を給餌したラットは高度の大動脈石灰化を発症しました。このラットにリン制限を同時に行うと、血管石灰化はほぼ完全に消失しました。すなわち、低タンパク餌はリン過負荷による血管石灰化を促進する因子であって、血管石灰化を直接引き起こすわけではないことを見出しました。一方で、リン制限を行った場合でも、血管石灰化の直接要因と考えられるCPPは完全には抑制できておらず、超低タンパク餌によってもたらされる石灰化抑制因子の低下がCPPの形成には重要であることが推測されます。
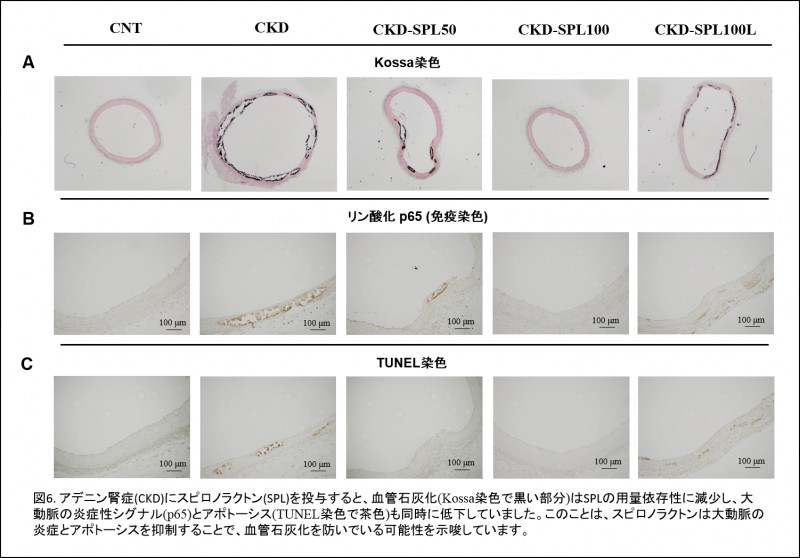
我々臨床家にとって、患者に投薬可能でありかつ血管石灰化抑制効果を有する薬剤を見出すことは、血管石灰化の病態機序を解明することと同等に重要なテーマです。CKDでは、腎臓や血管などの多くの臓器においてアルドステロン受容体シグナルが亢進していることが知られ、さらにこのシグナル伝達が動脈内膜の粥状硬化巣における石灰沈着を促進することも報告されています。我々は、同シグナルがCKDに合併する動脈中膜の石灰化においても核心的な役割を演じ、アルドステロン受容体拮抗薬であるスピロノラクトンを投与することでCKDに伴う血管石灰化の進展を抑制できるのではないかと考えるに至りました。
前述のアデニン腎症ラットにスピロノラクトンを投与し、スピロノラクトンの投与量依存性に血管石灰化の進展を抑制できること、CKDが進行して血管石灰化が既に形成された状態からスピロノラクトンの投与を開始した場合においても、スピロノラクトンは血管石灰化の進行を抑制できることを実証いたしました(図6)。この時、スピロノラクトンは血管石灰化部位の炎症やアポトーシスを抑えていることもわかりました。
今後の展望
CKD-MBDは、今やCKD領域の中でも屈指の最先端研究分野に成長しました。世界中の多くの研究者が先を競うようにCKD-MBDに関する興味深い知見を次々と発表し、CKD-MBDという未開の領野のフロンティアは急速に開拓されつつあります。おそらく、次の10年の間には、過去10年間に得られた何倍もの新知見を我々は手にすることになるでしょう。その一方で、研究が進めば進むほど、CKD-MBDの既知の部分は依然として氷山の一角に過ぎないということが、研究者の間でゆるぎない確信に変わりつつあります。
二次性副甲状腺機亢進症の研究からスタートした我々の研究は、現在、そのテーマの主軸を血管石灰化に据えています。今後、血管石灰化の本体と目されるCPPをターゲットにした研究を中心に血管石灰化の病態機序に関する研究をさらに深化・発展させていきたいと考えています。それと同時に、未だ脚光を浴びていないながらもCKD-MBDの根幹に関わる未開の領野を開拓し、CKD-MBD領域において世界を牽引するような研究室に発展させていきたいという遠大な目標も掲げています。
CKD-MBDは腎臓、骨、血管などの臓器間ネットワークの破綻に起因する、非常に複雑な病態です。CKD-MBDの研究も御多分に漏れず、ひとつひとつの小さな研究を着実に形にしながら積み重ね、世代を超えて連綿と続けていくべき地道な作業だと思います。そのためには、いつの時代にあっても、次時代を担う意欲に富んだ若い力が不可欠です。私たちの研究内容に興味を持っていただける先生方からの御連絡を心待ちにしています。 文責 山田俊輔(H15)
【関連文献】
1. Yamada S, Tokumoto M, Tsuruya K, Kitazono T, Ooboshi H. Very low protein diet enhances inflammation, malnutrition, and vascular calcification in uremic rat. Life Sci 2016;146:117-123.
2. Tatsumoto N, Arioka M, Yamada S, Takahashi-Yanaga F, Tokumoto M, Tsuruya K, Kitazono T, Sasaguri T. Inhibition of GSK-3β increases trabecular bone volume but not cortical bone volume in adenine-induced uremic mice with severe hyperparathyroidism. Physiol Rep. 2016;4:e13010.
3. Yamada S, Tokumoto M, Tatsumoto N, Tsuruya K, Kitazono T, Ooboshi H. Fetuin-A decrease induced by a low protein diet enhances vascular calcification in uremic rats with hyperphosphatemia.Am J Physiol Renal Physiol 2015;309:F744-F754.
4. Yamada S, Tatsumoto N, Tokumoto M, Noguchi H, Ooboshi H, Kitazono T, Tsuruya K. Phosphate binders prevent phosphate-induced cellular senescence of vascular smooth muscle cells and vascular calcification in a modified, adenine-based uremic rat model. Calcif Tissue Int 2015;96:347-358.
5. Tatsumoto N, Yamada S, Tokumoto M, Eriguchi M, Noguchi H, Torisu K, Tsuruya K, Kitazono T. Spironolactone ameliorates arterial medial calcification in uremic rats: the role of mineralocorticoid receptor signaling in vascular calcification. Am J Physiol Renal Physiol 2015;309:F967-F979.
6. Yamada S, Tokumoto M, Tatsumoto N, Taniguchi M, Noguchi H, Nakano T, Masutani K, Ooboshi H, Tsuruya K, Kitazono T. Phosphate overload induces systemic inflammation and malnutrition as well as vascular calcification in uremia. Am J Physiol Renal Physiol 2014;306:1418-1428.
7. Yamada S, Taniguchi M, Tokumoto M, Toyonaga J, Fujisaki K, Suehiro T, Noguchi H, Iida M, Tsuruya K, Kitazono T. The antioxidant tempol ameliorates arterial medial calcification in uremic rats: important role of oxidative stress in the pathogenesis of vascular calcification in chronic kidney disease. J Bone Miner Res 2012;27:474-485.
二次性副甲状腺機亢進症の研究からスタートした我々の研究は、現在、そのテーマの主軸を血管石灰化に据えています。今後、血管石灰化の本体と目されるCPPをターゲットにした研究を中心に血管石灰化の病態機序に関する研究をさらに深化・発展させていきたいと考えています。それと同時に、未だ脚光を浴びていないながらもCKD-MBDの根幹に関わる未開の領野を開拓し、CKD-MBD領域において世界を牽引するような研究室に発展させていきたいという遠大な目標も掲げています。
CKD-MBDは腎臓、骨、血管などの臓器間ネットワークの破綻に起因する、非常に複雑な病態です。CKD-MBDの研究も御多分に漏れず、ひとつひとつの小さな研究を着実に形にしながら積み重ね、世代を超えて連綿と続けていくべき地道な作業だと思います。そのためには、いつの時代にあっても、次時代を担う意欲に富んだ若い力が不可欠です。私たちの研究内容に興味を持っていただける先生方からの御連絡を心待ちにしています。 文責 山田俊輔(H15)
【関連文献】
1. Yamada S, Tokumoto M, Tsuruya K, Kitazono T, Ooboshi H. Very low protein diet enhances inflammation, malnutrition, and vascular calcification in uremic rat. Life Sci 2016;146:117-123.
2. Tatsumoto N, Arioka M, Yamada S, Takahashi-Yanaga F, Tokumoto M, Tsuruya K, Kitazono T, Sasaguri T. Inhibition of GSK-3β increases trabecular bone volume but not cortical bone volume in adenine-induced uremic mice with severe hyperparathyroidism. Physiol Rep. 2016;4:e13010.
3. Yamada S, Tokumoto M, Tatsumoto N, Tsuruya K, Kitazono T, Ooboshi H. Fetuin-A decrease induced by a low protein diet enhances vascular calcification in uremic rats with hyperphosphatemia.Am J Physiol Renal Physiol 2015;309:F744-F754.
4. Yamada S, Tatsumoto N, Tokumoto M, Noguchi H, Ooboshi H, Kitazono T, Tsuruya K. Phosphate binders prevent phosphate-induced cellular senescence of vascular smooth muscle cells and vascular calcification in a modified, adenine-based uremic rat model. Calcif Tissue Int 2015;96:347-358.
5. Tatsumoto N, Yamada S, Tokumoto M, Eriguchi M, Noguchi H, Torisu K, Tsuruya K, Kitazono T. Spironolactone ameliorates arterial medial calcification in uremic rats: the role of mineralocorticoid receptor signaling in vascular calcification. Am J Physiol Renal Physiol 2015;309:F967-F979.
6. Yamada S, Tokumoto M, Tatsumoto N, Taniguchi M, Noguchi H, Nakano T, Masutani K, Ooboshi H, Tsuruya K, Kitazono T. Phosphate overload induces systemic inflammation and malnutrition as well as vascular calcification in uremia. Am J Physiol Renal Physiol 2014;306:1418-1428.
7. Yamada S, Taniguchi M, Tokumoto M, Toyonaga J, Fujisaki K, Suehiro T, Noguchi H, Iida M, Tsuruya K, Kitazono T. The antioxidant tempol ameliorates arterial medial calcification in uremic rats: important role of oxidative stress in the pathogenesis of vascular calcification in chronic kidney disease. J Bone Miner Res 2012;27:474-485.






