基礎研究
腎交感神経の心腎連関に対する役割
はじめに
近年,カテーテルデバイスによる腎交感神経切除が試験的に臨床使用されていますが,
その有効性の機序については十分に解明されていません.
しかしながら,多くの臨床医は,
このデバイスが臨床的に難治性である心腎連関に対して魅力的なターゲットになりうると期待しています.
本研究では,腎交感神経切除の心腎連関に対する有効性について,
局所のレニン-アンジオテンシン系(RAS)に注目して研究しました.
その有効性の機序については十分に解明されていません.
しかしながら,多くの臨床医は,
このデバイスが臨床的に難治性である心腎連関に対して魅力的なターゲットになりうると期待しています.
本研究では,腎交感神経切除の心腎連関に対する有効性について,
局所のレニン-アンジオテンシン系(RAS)に注目して研究しました.
背景
高血圧,糖尿病や肥満などの生活習慣病により心臓,腎臓は個々に傷害されるだけでなく,
両臓器の傷害は双方性にその傷害を更に強めあい,心腎連関として認知されています.
心腎連関の臓器障害の進行の過程において,レニン-アンジオテンシン系(RAS)や交感神経活動(SNA)の亢進
ならびに一酸化窒素(NO)の低下が認められ,
互いが複雑に干渉しながら心腎連関の悪循環を形成しています.
また,病的な状況において慢性的な局所RASの上昇は臓器不全をひきおこすことが知られており,
腎臓内での上昇は高血圧や腎不全,心臓では心筋肥大や線維化を生じます.
しかし,局所RASの制御については十分に解明されておらず,腎組織内におけるアンジオテンシノーゲン(AGT)の
由来についても,近位尿細管での局所産生と循環AGTの糸球体からの排泄の2つの機序が提唱されています.
我々は慢性的NO阻害による心・腎傷害モデルを使用して,
このモデルで認められる交感神経-RAS亢進の悪循環に対する腎交感神経切除の有効性を検討しました.
両臓器の傷害は双方性にその傷害を更に強めあい,心腎連関として認知されています.
心腎連関の臓器障害の進行の過程において,レニン-アンジオテンシン系(RAS)や交感神経活動(SNA)の亢進
ならびに一酸化窒素(NO)の低下が認められ,
互いが複雑に干渉しながら心腎連関の悪循環を形成しています.
また,病的な状況において慢性的な局所RASの上昇は臓器不全をひきおこすことが知られており,
腎臓内での上昇は高血圧や腎不全,心臓では心筋肥大や線維化を生じます.
しかし,局所RASの制御については十分に解明されておらず,腎組織内におけるアンジオテンシノーゲン(AGT)の
由来についても,近位尿細管での局所産生と循環AGTの糸球体からの排泄の2つの機序が提唱されています.
我々は慢性的NO阻害による心・腎傷害モデルを使用して,
このモデルで認められる交感神経-RAS亢進の悪循環に対する腎交感神経切除の有効性を検討しました.
研究方法
WistarラットにNO合成酵素阻害薬(L-NAME)を慢性投与した心腎連関モデルを作成しました.
L-NAME投与のみのL-NAME群,L-NAME+両側の腎交感神経切除を施行したL-NAME + Bil. DNx群,
L-NAME+ヒドララジン投与を行ったL-NAME + Hyd群,およびL-NAME非投与のControl群で比較しました.
腎交感神経切除の直接的な腎保護効果を検討するために,L-NAME投与下で片側のみ腎交感神経を切除したモデルを
使用して,切除側と非切除側の腎内RASおよび腎傷害を比較しました.
成果
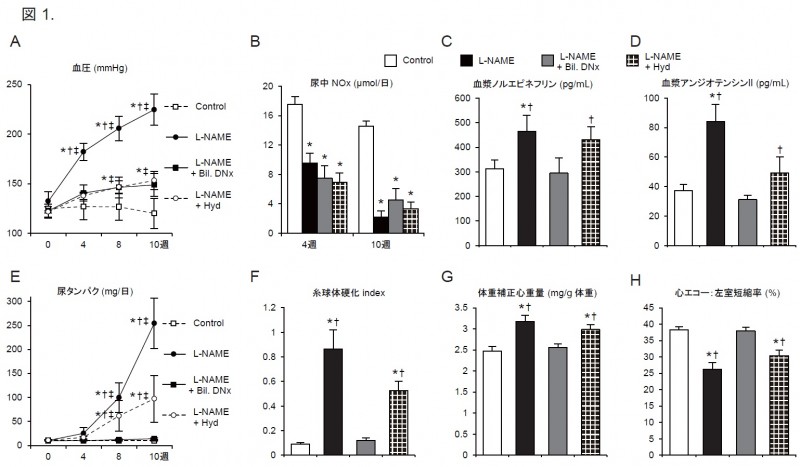
また,尿中AGT増加,心臓および腎臓でのAGTタンパク発現量の増加(図2.A, E)および
組織内アンジオテンシンIIレベルの上昇が認められ,両臓器での組織RASは亢進していました.
臓器傷害の評価では,経時的な尿タンパク量(図1.E),糸球体硬化(図1.F),両臓器での間質の線維化4,
心重量の増加(図1.G)および心エコーにおける求心性肥大と左室収縮力障害(図1.H)が認められます.
L-NAMEが投与された3群(L-NAME群,L-NAME + Bil. DNx群,L-NAME + Hyd群)において
NOは同等に抑制されていましたが(図1.B),L-NAME + Bil. DNx群での臓器障害はcontrol群と同等まで
軽減されていました(図1.C-H).
しかし,L-NAME + Bil. DNx群と同等に血圧を下げたL-NAME + Hyd群では,
十分な軽減効果は認められませんでした(図1.C-H).
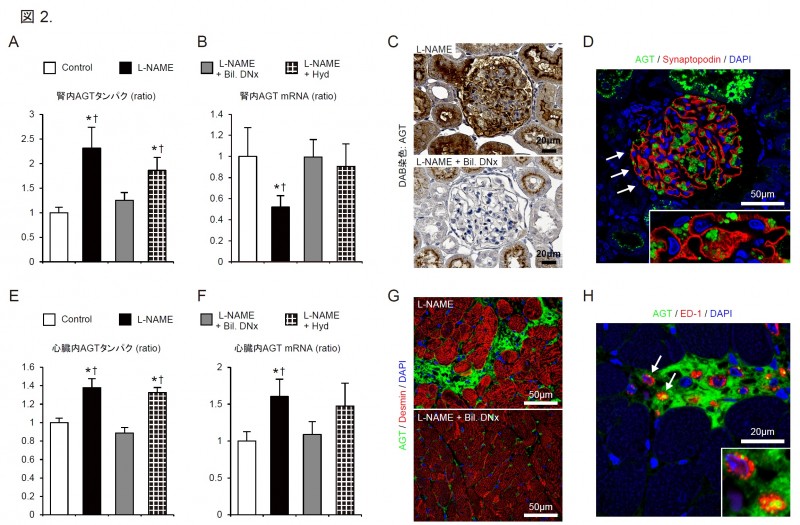
AGT mRNAは両臓器で正反対に制御されていました.
すなわち,心臓ではAGT mRNA発現量が増加し,
逆に腎臓ではAGT mRNA発現量が抑制されていました(図2.B,F).
共焦点レーザー顕微鏡による検討で,心臓では障害されてAGTタンパクの強発現を認める間質領域に
AGTタンパクを含有したマクロファージの浸潤を多数認め(図2.G,H),
浸潤マクロファージによる心筋局所でのAGT産生が示唆されました.
一方,腎臓では傷害された糸球体上皮細胞スリット間隙および近位尿細管でAGTタンパクの強発現を認め,
糸球体から排泄された循環AGTの近位尿細管での取り込みが示唆されました(図2.C,D).
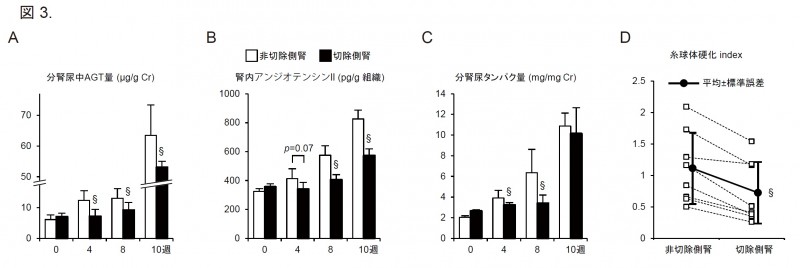
直接的な腎臓への作用を検討しています.
両側腎交感神経切除とは異なり,片側腎交感神経切除ではL-NAME投与による血圧上昇,局所RASの亢進
および両臓器障害は経時的に進行しました.
しかし,腎交感神経切除側の腎は有意に重量が重く,分腎尿での尿蛋白量と尿中AGT,腎内アンジオテンシンII
および糸球体硬化は軽減されていました(図3).
つまり,腎交感神経の直接的な局所RASの調節および腎保護作用が示されました.
文,図 江里口雅裕(H12)






